PENDAHULUAN
Sebagai
negara kepulauan yang dikelilingi laut, Indonesia mempunyai sumber daya hayati
maupun non hayati. Selain perairan laut, luas daratan Indonesia juga menyimpan
perairan tawar yang memiliki potensi sumber daya alam yang dapat dimanfaatkan
untuk kesejahteraan penduduk Indonesia seperti ikan yang merupakan sumber
penyediaan protein hewani (Kordi, 2004). Ikan merupakan jasad multiseluler,
sel-sel penyusun jaringan-jaringan yang selanjutnya membentuk kelompok kerja
yang kompleks dengan struktur spesifik yang disebut organ (Irianto, 2005).
Permintaan
ikan di masyarakat semakin meningkat, sehingga untuk memenuhi permintaan
tersebut perlu adanya peningkatan produksi (Ismargono, 1996).
Dalam budidaya ikan, penyakit ikan dapat mengakibatkan kerugian ekonomis karena
penyakit dapat menyebakan kekerdilan, periode pemeliharaan lebih lama,
tingginya konversi pakan dan kematian. Penyakit ikan berhubungan erat dengan
lingkungan dimana ikan berada. Oleh karena itu dalam pencegahan dan pengobatan
penyakit ikan, selain dilakukan pengendalian terhadap lingkungan juga perlu
diketahui hal-hal yang berkaitan dengan timbulnya penyakit ikan itu
sendiri (Anonim, 2008a).
Menurut
Irianto (2005), Penyakit meliputi penyakit infeksi dan bukan infeksi. Penyakit
infeksi merupakan masalah utama, meliputi penyakit-penyakit yang disebabkan
oleh virus, bakteri, fungi, dan parasit. Sakit dapat pula akibat defisiensi
atau malnutrisi, atau sebab-sebab lain.
Salah
satu penyakit yang sering ditemukan pada ikan adalah penyakit bakterial dan
ektoparasit. Penyakit bakterial yang sering menjadi kendala adalah yang
disebabkan oleh Aeromonas hydrophila. Bakteri tersebut umumnya
hidup di air tawar, tanaman air, dan tubuh ikan, sehingga berpeluang besar
untuk menginfeksi pada saat pertahanan tubuh menurun akibat stres sedangkan
penyakit parasit eksternal yang dikenal menyerang ikan adalah Dactylogyrus
sp yang merupakan cacing monogenea (Kordi, 2004).
Tujuan
dari koasistensi diagnosa laboratorik ini adalah untuk mengetahui penyebab
penyakit pada ikan dengan melakukan pemeriksaan patologi, parasitologi,
mikrobiologi, dan patologi klinik. Melalui pemeriksaan ini diharapkan dapat
memberikan informasi pada peternak atau pemilik hewan sehingga kemudian dapat
dilakukan tindakan pencegahan terhadap penyakit-penyakit ikan.
Berdasarkan anamnesa diketahui gejala klinis yang tampak adalah ikan
berenang megap-megap dan berada di permukaan, sisik lepas dan adanya lesi
kemerahan pada lateral tubuh.. Pakan yang diberikan berupa pelet dan lumut.
Ikan mas dengan nomor protokol E.42 dipelihara dalam kolam berukuran 7 x 3 x 1
m3 dengan populasi ikan 250 ekor.
TINJAUAN PUSTAKA
Ikan Mas (Cyprinus carpio)
Ikan mas termasuk dalam Filum: Chordata; Kelas:
Actinopterygii;Ordo: Cypriniformes; Familia:
Cyprinidae; Genus: Cyprinus; Species:
Cyprinus carpio
(Anonim, 2008b).
Ikan mas merupakan jenis ikan konsumsi air tawar, berbadan
memanjang pipih kesamping dan lunak. Ikan mas sudah dipelihara sejak tahun 475
SM di Cina. Di Indonesia ikan mas mulai dipelihara sekitar tahun 1920. Ikan mas
yang terdapat di Indonesia merupakan ikan mas yang dibawa dari Cina, Eropa,
Taiwan dan Jepang. Ikan mas Punten dan Majalaya merupakan hasil seleksi di
Indonesia. Budidaya ikan mas telah berkembang pesat di kolam
biasa, di sawah, waduk, sungai air deras,
bahkan ada yang dipelihara dalam keramba
di perairan umum (Anonim, 2008c).
Di Indonesia, ikan
mas memiliki beberapa nama sebutan yakni ikan Kancera, Tikeu, Tombro, Raja, Rayo, Ameh atau nama lain sesuai dengan
daerah penyebarannya. Ras-ras ikan mas yang ada di Indonesia dapat digolongkan
menjadi dua kelompok berdasarkan fungsinya. Kelompok pertama merupakan ras-ras
ikan konsumsi dan kelompok kedua adalah ras-ras ikan hias (Anonim, 2008d)
Perbedaan sifat dan ciri dari ras disebabkan oleh adanya interaksi antara
genotipe dan lingkungan kolam, musim dan cara pemeliharaan yang terlihat dari
penampilan bentuk fisik, serta bentuk tubuh dan warnanya. Tanah yang baik untuk
kolam pemeliharaan ikan mas adalah jenis tanah liat/lempung dan tidak berporos.
Jenis tanah tersebut dapat menahan massa air yang besar dan tidak bocor
sehingga dapat dibuat pematang/dinding kolam. Ikan mas dapat tumbuh normal,
jika lokasi pemeliharaan berada pada ketinggian antara 150-1000 m dpl. Kualitas
air untuk pemeliharaan ikan mas harus bersih, tidak terlalu keruh dan tidak
tercemar bahan-bahan kimia beracun, dan minyak/limbah pabrik. Ikan mas dapat
berkembang pesat di kolam, sawah, kakaban, dan sungai air deras. Kolam dengan
sistem pengairan yang mengalir sangat baik bagi pertumbuhan dan perkembangan
fisik ikan mas. Suhu air yang baik berkisar antara 20-25º C (Muda, 2007).
Aeromonas
hydrophila
Infeksi
bakteri merupakan salah satu masalah yang serius dalam pemeliharaan ikan,
karena itu diagnosa yang dilakukan terhadap penyakit bakterial harus dilakukan
dengan setepat mungkin. Selama bertahun-tahun banyak bakteri yang sudah dapat
diidentifikasi sebagai penyebab sakit pada ikan salah satunya Aeromonas (Dixon, 1990). Aeromonas terdapat di air tawar, tanah
dan pada ikan (Post, 1987). Merupakan bakteri patogen oportunik yang dapat
menjadi fatal jika lingkungan kurang bagus, hospes lemah, atau patogen utama.
Bakteri
Aeromonas termasuk ke dalam family Pseudomonadaceae
dan terdiri dari tiga spesies utama, yaitu A. punctata, A.hydrophila
dan A.liquiefacieus yang bersifat patogen. Bakteri Aeromonas
umumnya hidup di air tawar, terutama yang mengandung bahan organik tinggi. Ada
pula yang berpendapat bahwa bakteri Aeromonas dapat hidup dalam saluran
pencernaan (Afrianto dan Liviawaty, 1992).
Aeromonas hydrophila merupakan bakteri bersifat Gram negatif dan berbentuk batang. Merupkan
agensia penyebab penyakit hemoragik septikemia (Bacterial Hemorrhagic
Septicemia) atau MAS (Motile Aeromonas Septicaemia) atau ulcer disease atau red
sore disease pada beragam spesies ikan air tawar (White, 1991). Pada umumnya Aeromonas hydrophila merupakan oportunis
karena penyakit yang disebabkannya mewabah pada ikan-ikan yang mengalami stress
atau pada pemeliharaan dengan padat tebaran yang tinggi.
Aeromonas
hydrophila dapat diisolasi dari ginjal
atau darah pada media nutrien biasa. Koloni berwarna putih kekuningan,
circular, conveks terbentuk dalam waktu 24 jam pada suhu 22-28°C. Aeromonas hydrophila mungkin penyebab
paling penting wabah penyakit yang parah pada ikan air tawar yang dibudidaya di
kolam dan ikan liar (Roberts, 2001).
Aeromonas
hydrophila dapat dibedakan dari Aeromonas
salmonicida dengan uji-uji biokemis. Perbedaan karakter atau sifat-sifat biokimia
antara Aeromonas salmonicida dengan Aeromonas hydrophila:
Ikan
yang terinfeksi Aeromonas hydrophila biasanya pada keadaan stress karena
suatu faktor dan menunjukkan warna yang lebih gelap dengan hemoragi iregular
yang luas pada permukaan tubuh dan basis (pangkal) sirip serta ascites.
Hemoragi pada permukaan tubuh mungkin mengalami ulserasi membentuk lesi nekrotik
yang dangkal. Terdapat lesi kulit dasar sirip dengan area hemoragi yang
bervariasi dan nekrosis hingga ke otot.
Organ internal pada ikan yang dinekropsi terlihat kongesti dengan
hemorhagi pada organ dalam (Roberts, 2001). Hemorrhagic septicaemia juga
ditandai dengan adanya lesi permukaan yang kecil, sering diikuti dengan
lepasnya sisik, hemorhagi lokal biasanya pada insang, ulser, abses, exopthalmia
dan distensi abdominal. Organ bagian dalam mungkin mengalami akumulasi cairan
asites, anemia dan kerusakan organ terutama ginjal dan hati (Austin dan Austin,
1987).
Tampak
adanya nekrosis pada ren, jaringan hemopoetik lien, begitu pula terjadi pada
jantung, hati, dan pankreas. Selaput mukosa intestinal biasanya mengalami
nekrosis dan terlepas ke lumen, kulit mengalami oedema yang parah pada bagian
dermis dan hiperemia pada stratum retikularis, epidermis mengalami spongiosis
dan ulserasi diikuti nekrosis hemorhagik sampai ke otot bagian bawah, tetapi
biasanya lesinya lebih superfisial daripada vibriosis (Moeller, 2001).
Pengendalian
dilakukan dengan antibiotik atau sulfonamid yang poten, tetapi ikan yang
terinfeksi biasanya anoreksia, pengobatan secara parenteral mungkin diperlukan.
Pengobatan harus diikuti dengan perbaikan lingkungan dan menghilangkan stressor
(Roberts, 2001).
Dactylogyrus
sp.
Dactylogyrus sp termasuk dalam filum: Vermes; Sub filum:
Platyhelminthes; Kelas: Trematoda; Ordo: Monogenea; Famili: Gyrinidae; Genus:
Dactylogyrus; Spesies: Dactylogyrus sp.
(Handajani dan Samsundari, 2005).
Dactylogyrus merupakan cacing pipih (fluke) yang termasuk dalam parasit kelas trematoda monogenea.
Cacing ini banyak menginfeksi ikan (Griffiths, 2008). Dactylogyrus memiliki alat penyerang yang disebut haptor atau ophishaptor.
Sistem pencernaan sangat sederhana, mulut pada ujung anterior, dikelilingi oleh
alat penghisap (Levine, 1994). Panjang parasit ini 0,2-0,5 mm dengan panjang
maksimumnya 2.0 mm dan bagian posterior dilengkapi dengan 7 pasang kait tepi (marginal
hooks) dan terdapat 1 pasang kait tengah (median hooks) pada
ophishaptornya serta di bagian anterior terdapat 2-4 pigment spot atau
mata (Anonim, 2005).
Siklus
hidup Dactylogyrus adalah secara langsung. Telur menetas kemudian menjadi
larva bersilia yang disebut oncomiracidium, yang menyerang hospes atau
hanya hidup bebas di air sebelum menempel pada hospes. Oncomiracidium
menyerang hospes melalui organ posteriornya yang disebut opisthaptor
(Anonim, 2000). Dactylogyrus sp. termasuk ovipar (Anonim, 2007).
Telurnya sangat tahan terhadap senyawa kimia atau desinfektan sehingga untuk
pemberantasan memerlukan tindakan yang bertahap dengan menggunakan lebih dari
satu metode atau agensia pengendali parasit (Irianto, 2005).
Pada ikan air
tawar, monogenea mampu membuat insang menjadi pucat dan swollen, membuat
respirasi meningkat, dan ikan menjadi rendah toleran terhadap oksigen. Sebagian
besar monogenea baik yang menyerang kulit maupun insang mampu membuat perubahan
yang berarti pada tingkat kerusakan dan mortalitas. Infeksi sekunder dari
bakteri dan jamur dapat terjadi pada jarinngan yang telah rusak oleh monogenea
(Reed et al, 2005). Semua Dactylogyrus sp. akan merangsang sekresi
mukus berlebihan, dapat menyebabkan tepi lamella insang tercabik atau luka.
Pada infeksi berat akan mengganggu penyerapan oksigen sehingga ikan kekurangan
oksigen dan operkula memerah (Irianto, 2005). Kulit juga pucat, bintik-bintik
merah dibagian tubuh tertentu, produksi lendir tidak normal dan pada sebagian
atau seluruh tubuh berwarna lebih gelap, sisik dan kulit terkelupas. Organ
target Dactylogyrus adalah lamela
primer (Kordi, 2004).
Parasit ini akan terlihat bila
filamen insang dipisahkan dari arkus insang dan ditaruh pada kaca obyek yang
ditutupi kaca penutup lalu diperiksa, karakteristik identifikasi berdasarkan
kait dan matanya (Anonim, 2004).
MATERI DAN METODE
Materi
Pada kasus ini digunakan seekor ikan mas dengan nomor protokol E.42.
Peralatan yang digunakan adalah peralatan standar untuk nekropsi hewan, alat
dan bahan untuk pemeriksaan makroskopis dan mikroskopis di laboratorium
patologi, alat dan bahan untuk pemeriksaan parasit di laboratorium
parasitologi, alat dan bahan untuk pemeriksaan bakteri di laboratorium
mikrobiologi dan alat dan bahan untuk pemeriksaan darah di laboratorium
patologi klinik.
Metode
Sebelum ikan dieutanasi dan dinekropsi, dilakukan anamnesa, pemeriksaan
fisik dan pengambilan darah. Pengambilan darah dilakukan melalui vena caudalis
dengan spuit 3ml kemudian dibuat preparat apus darah pada obyek gelas,
disamping itu juga ditampung pada tabung yang berisi EDTA. Preparat apus darah
difiksasi dengan methanol kemudian dilakukan pengecatan Giemza untuk
pemeriksaan diferensial leukosit, sedang darah yang diberi EDTA dipakai untuk
pemeriksaan darah rutin meliputi penghitungan jumlah eritrosit dan leukosit,
total protein plasma, fibrinogen, kadar Hb, MCV, MCH dan MCHC.
Eutanasi dengan menggunakan minyak cengkeh, kemudian dilaksanakan nekropsi.
Pemeriksaan makroskopik dilakukan dengan inspeksi sedang pemeriksaan
mikroskopis dengan pembuatan preparat histopatologi dari organ yang dicurigai.
Pemeriksaan parasitologi dilakukan dengan metode skin scraping, gill wet
mount, imprint, smear, squash dan preparat apus darah.
Pemeriksaan mikrobiologi untuk mendeteksi Aeromonas dilakukan dengan menggunakan media PAD, Mac Concey, TSI, Agar
miring, uji KOH 3%, uji oksidase, uji katalase, pengecatan sederhana, uji
gula-gula, IMViC, uji gelatin, oksidatif dan fermentatif, Agar 4%. Organ yang
dipakai sebagai bahan isolasi yaitu hepar dan kulit yang mengalami lesi.
HASIL PEMERIKSAAN LABORATORIUM
I. Laboratorium
Patologi
Pemeriksaan makroskopik:
Insang : berwarna merah gelap.
Kulit : lesi kemerahan pada dexter dan sinister tubuh dan sekitar mulut, sisik
lepas, produksi mukus berlebih.
Hepar : warna merah gelap, konsistensi rapuh,
bidang sayatan berdarah.
Pemeriksaan mikroskopik :
Insang : proliferasi
epitel lamella sekunder, adesi lamella sekunder, infiltrasi heterofil,
peningkatan jumlah eritrosit di pembuluh darah lamella primer, dan infiltrasi
limfosit pada lamella primer.
Kulit : erosi
epidermis dan dermis, infiltrasi limfosit pada hipodermis.
Hepar : infiltrasi
limfosit dan akumulasi eritrosit pada sinusoid.
Ren : vakuola
pada sitoplasma epitel tubulus.
Jantung : infiltrasi
limfosit pada endokardium
Kesimpulan :
Berdasarkan hasil pemeriksaan
tersebut maka disimpulkan bahwa ikan mas (Cyprinus carpio) dengan nomor protokol E.42
mengalami branchitis, dermatitis, hepatitis, nefrosis, dan endokarditis.
II. Laboratorium Mikrobiologi
Bahan pemeriksaan : kulit
Jenis pemeriksaan : isolasi dan identifikasi Aeromonas
hydrophila.
Hasil pemeriksaan:
Berdasarkan hasil pemeriksaan tersebut maka dapat
disimpulkan bahwa sampel ikan mas (Cyprinus carpio) dengan nomor
protokol E.42 terisolasi Aeromonas hydrophila.
III. Laboratorium Parasitologi
Spesimen : insang, lesi kulit, hepar, darah.
Hasil pemeriksaan :
1. Gill wet mount : (+) positif : Dactylogyrus sp.
2. Skin scraping : (+) positif : Dactylogyrus
Sp.
3. Imprint hepar : (-) negatif
4. Smear hepar : (-) negatif
5. Squash hepar : (-) negatif
6. Preparat apus darah : (-) negatif
Kesimpulan :
Berdasarkan hasil pemeriksaan tersebut ikan mas (Cyprinus carpio) dengan
nomor protokol E.42 terinfeksi Dactylogyrus
sp.
IV. Laboratorium Patologi Klinik
Bahan Pemeriksaan :darah dengan antikoagulan EDTA dan preparat apus darah dengan pengecatan
Giemza.
Kesimpulan :
Berdasarkan
hasil pemeriksaan darah dilaboratorium patologi klinik, maka ikan dengan
protokol E.42 mengalami
anemia makrositik hipokromik, dengan heterofilia, limfopenia dan monositosis,
anisositosis, dan poikilositosis.
DISKUSI
Ikan Mas (Cyprinus
carpio) dengan nomor protokol E.42 menunjukkan gejala klinis antara lain
berenang megap-megap di permukaan air, terdapat lesi kemerahan pada lateral
tubuh. Berdasarkan pemeriksaan makroskopik yang dilakukan di Laboratorium
Patologi terdapat perubahan yang menciri dengan adanya lesi kemerahan pada dexter
dan sinister tubuh dan sekitar mulut, sisik lepas, produksi mukus berlebih.
Berdasarkan gejala klinis dan perubahan makroskopik yang teramati, maka ikan
mas dengan nomor protokol E-25 diduga mengalami infeksi Aeromonas sp.
Dugaan
adanya infeksi Aeromonas sp. diambil berdasarkan lesi yang terdapat pada kulit dimana tampak
adanya bercak merah (hemoragi) di permukaan tubuh ikan. Menurut Moeller (2001)
salah satu tanda adanya infeksi Aeromonas hydrophila yaitu adanya
hemoragi pada kulit, dasar sirip, dan muskulus dengan ulser superfisialis pada
epidermis kulit.
Setelah ikan dilakukan autopsi, dilakukan pengamatan terhadap organ. Bagian
yang tampak mengalami perubahan antara lain adalah pada bagian hepar tampak berwarna merah tua dengan
konsistensi rapuh dan bidang sayatan berdarah. Organ kemudian dibuat preparat histopatologi guna
pemeriksaan lebih lanjut.
Pada hepar tampak adanya akumulasi eritrosit yang
berlebihan pada sinusoid. Hal
ini sesuai dengan pernyataan Camus dkk (1998), pada infeksi Aeromonas
hydrophila dapat mengakibatkan kongesti pada jaringan viscerall.
Pada ginjal tampak adanya vakuola pada sitoplasma epitel
tubulus dan nekrosis tubulus. Menurut Moller
(2001), penyakit ikan yang disebabkan oleh bakteri Gram negatif mempunyai
manifestasi pada organ viscerall dengan terjadi degenerasi dan dapat melanjut
menjadi nekrosis. Sel
yang rusak oleh toksin bakteri Aeromonas hydrophila akan mengalami
degenerasi ataupun nekrosis (Govan dkk., 1981). Pada ginjal ikan yang merupakan organ
haemopoietic, dimana berfungsi sebagai penghasil leukosit, sehingga kejadian
nekrosis pada ren sangat jarang, tetapi jika terjadi infestasi radang maka akan
di tunjukkan dengan adanya inclusion bodies (benda asing) pada jaringan
interstitial (Robert, 1989).
Insang pada pemeriksaan histopatologi tampak
adanya infiltrasi heterofil dan limfosit baik pada lamella primer maupun
sekunder. Proliferasi sel epitel pada lamella sekunder mengakibatkan terjadinya
fusi. pada jantung terdapat infiltrasi limfosit pada epikardium
dan pada kulit tampak adanya erosi epitel di epidermis dan dermis serta tampak
adanya infiltrasi limfosit pada hipodermis. Infiltrasi
sel radang berfungsi untuk fagositosis dan menghancurkan agen asing, dalam hal
ini fagositosis dan penghancuran terhadap sel bakteri Aeromonas
(Roberts, 1989).
Pengamatan pada preparat histopatologi menunjukkan ikan
mengalami branchitis, dermatitis, hepatitis, nefrosis, epikarditis.
Diagnosa sementara adalah adanya infeksi Aeromonas
hydrophila pada ikan mas tersebut. Diagnosa sementara ini diambil
berdasarkan gejala klinis yang tampak, perubahan patologis pada organ visceral
serta lesi yang ditemukan pada kulit dimana tampak adanya bercak merah pada
kulit, baik secara makroskopik maupun mikroskopik.
Guna meneguhkan diagnosa adanya infeksi Aeromonas
hydrophila maka dilakukan pemeriksaan pada laboratorium Mikrobiologi dengan
metode isolasi dan identifikasi bakteri.
Sampel yang digunakan adalah kulit dan hepar yang mengalami perubahan. Pertama
bakteri di tanam pada media plate agar darah (PAD) dan Mac Conkey karena
bakteri Aeromonas hydrophila merupakan bakteri Gram negatif. Mac Conkey
agar merupakan media selektif untuk bakteri Gram negatif, dengan garam empedu
dan kristal violet sebagai inhibitor Gram positif.
Pada media Mac Conkey tumbuh adanya koloni bakteri hasil
ini sesuai dengan Chong dkk (1980), Quinn (2002), Adanir dkk (2007) dan
Abulhamd (2009) yang menyebutkan bahwa Aeromonas hydrophilla dapat
tumbuh pada media Mac Conkey agar. Koloni bakteri yang tumbuh adalah berbentuk
sirkuler, tepi entire, permukaan konveks, warna koloni putih kekuningan dengan
sifat fermented laktosa, hal ini sesuai dengan Roberts (1989), yang
menyebutkan bahwa morfologi koloni bakteri Aeromonas hydrophila berwarna
putih sampai kuning tua, berbentuk sirkuler, dan konveks (Roberts, 1989). Bakteri
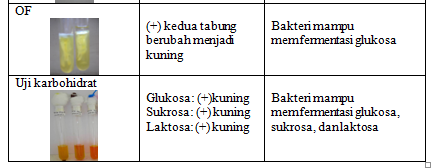
selanjutnya ditanam pada media TSI dengan hasil bagian miring kuning (asam) dan
bagian tegak kuning (asam) hal ini berarti bahwa Bakteri mampu memfermentasikan
glukosa, laktosa, dan atau sukrosa. Tidak menghasilkan H2S (Chong
dkk, 1980 ; Sirirat, 1999). Kemudian dilakukan penanaman pula pada media agar
miring dan di inkubasi pada suhu 37oC untuk mengetahui kemampuan
pertumbuhan bakteri pada suhu 37oC.
Pengecatan sederhana dilakukan untuk
mengetahui morfologi sel bakteri. Secara mikroskopik, bakteri yang di
cat berbentuk batang pendek (cocobacill). Hal ini sesuai dengan Austin
dkk (1987), Carnahan dkk (1991), Jenkins
(1995), Yambot (1998), Sirirat (1999), Asmat dkk (2002), Quinn (2002), Adanir
(2007) dan Abdulhamd (2009) yang menyatakan bahwa Aeromonas hydrophila
adalah bakteri Gram-negatif berbentuk batang.
Pada
uji katalase terbentuk gelembung gas setelah H2O2 diberi
biakan artinya bakteri mempunyai enzim katalase yang mampu menguraikan H2O2
menjadi H2O dan O2 yang tampak sebagai gelembung
gas. Pada uji oksidase tampak kertas oksidase yang telah ditempelkan pada
koloni warnanya berubah menjadi biru dalam waktu kurang dari 10 detik, berarti
bakteri mempunyai enzim sitokrom oksidase.
Uji selanjutnya dilakukan pada media biokemis, yaitu
gula-gula (glukosa, laktosa dan sukrosa). Pada semua media yaitu glukosa, laktosa
dan sukrosa, warna media berubah menjadi kuning. Hal ini berarti bahwa bakteri
mampu memfermentasikan glukosa, laktosa dan sukrosa.
Uji lainnya yaitu uji Pepton, Methyl-Red (MR), Voges
Proskauer (VP) dan Sitrat. Pada uji pepton terbentuk cincin merah, yang berarti bakteri mampu memproduksi Indol dari media Tryptone
water yang kaya akan tryptophane. Hasil ini
sesuai dengan Austine dkk (1987), Carnahan dkk (1991), Yambot (1998),
Sirirat (1999), Adanir dkk (2007), Ibrahem (2008), Abdulhamd (2009) yang
menyatakan bahwa Aeromonas hydrophila
memberikan hasil positif pada uji indol. Pada uji MR hasil yang didapat adalah
media tidak berubah warna menjadi merah. Pada uji VP hasil yang didapat adalah
media berubah warna menjadi merah, hal ini sesuai dengan Carnahan dkk (1991),
Jenkins dkk (1995), Yambot (1998), Sirirat (1999), Abdulhamd (2009) yaitu bahwa
bakteri mampu membentuk acetyl-methyl-carbinol dari glukosa. Pada uji Citrat,
hasil yang didapatkan adalah media berubah menjadi keruh, yang berarti
bahwa bakteri mampu menggunakan sitrat sebagai sumber karbon.
Pada uji Gelatin memperoleh hasil
positif yaitu media tetap cair, hal ini
berarti bakteri mampu untuk membentuk enzim semacam proteolitik (gelatinase)
yang mencairkan gelatin. Sedangkan untuk uji NaCl 4% juga memperoleh hasil
positif yaitu bakteri mampu tumbuh pada kadar NaCl 4% hal ini sesuai dengan
Lucky dkk (1993).
Dari
hasil di atas maka dapat disimpulkan bahwa bakteri tersebut adalah Aeromonas
hydrophila.
Pemeriksaan parasit dilakukan pada hari yang sama dengan
waktu autopsi. Sampel
yang digunakan dalam pemeriksaan parasit adalah kerokan kulit, hepar, insang dan
darah. Tidak dilakukan pemeriksaan pada feses karena tidak didapatkan feses
pada ikan tersebut. Kulit dilakukan pemeriksaan kerokan kulit didapatkan hasil
positif Dactylogyrus sp.
Hepar diperiksa dengan metode smear, imprint dan squash,
hasil yang di dapatkan adalah negatif. Insang diperiksa dengan metode gill
wet mount, dan hasil yang di dapatkan adalah positif Dactylogyrus sp. Identifikasi pertama berdasarkan bentuk cacing yang
pipih dorsoventral, tidak berongga, semua organ berada dalam organ berparenkim,
tubuh pipih dorsoventral, tidak bersegmen, bentuk seperti daun (Levine, 1994)
dan terdapat 2 eyespot pada anterior parasit (Anonim, 2005).
Dactylogyrus
sp cenderung melekat pada insang dengan anchor yang dapat
menyebabkan tepi lamella insang tercabik. Pada infeksi berat dapat menyebabkan
gangguan penyerapan oksigen sehingga ikan kekurangan oksigen (Irianto, 2005).
Pemeriksaan darah dilakukan di laboratorium patoligi klinik.
Hasil pemeriksaan hematologi menunjukkan ikan mas dengan nomor protokol E.42
mengalami anemia makrositik hipokromik, heterofilia, limfopenia dan monositosis
serta anisositosis dan poikilositosis. Hal ini dapat dikaitkan dengan adanya
infeksi Aeromonas hydrophila dan infestasi Dactylogyrus sp. pada ikan tersebut.
Berdasarkan perhitungan, jumlah total eritrosit normal, PCV meningkat
dan hemoglobin mengalami penurunan dibandingankan standar normal, sehingga ikan
mas dikatakan mengalami anemia. Anemia merupakan keadaan yang menggambarkan
kondisi penurunan jumlah eritrosit, hemoglobin atau keduanya dalam sirkulasi
darah (benjamin, 1978). Anemia
makrositik hipokromik adalah keadaan dimana terjadi peningkatan MCV sedangkan
MCHC mengalami penurunan. MCV meningkat menunjukkan kondisi peningkatan
aktifitas organ hemopoitik akibat proses hemoragi atau perdarahan sebagai
respon regeneratif (Benjamin, 1978). Hal ini terlihat dengan adanya eritrosit
dengan bermacam-macam ukuran (anisositosis) dan bentuk (poikilositosis) dan
terwarnai tidak sempurna oleh hemoglobin, sehingga sitoplasma tercat bening.
Berdasarkan kemampuannya dalam regenerasi, anemia makrositik hipokromik,
merupakan anemia regeneratif. Anemia regeneratif, dimana tubuh mampu merespon
anemia dengan memproduksi eritrosit sebagai kompensasi, biasanya diakibatkan karena hilangnya darah
(hemoraghi) atau destruksi eritrosit (Aird., 2000). Mikrositosis merupakan
respon akibat pendarahan kronis yang disebabkan ketidak mampuan tubuh untuk
memproduksi eritrosit normal (Kociba, 2000).
Pada pemeriksaan preparat apus darah, darah mengalami
anisositosis. Tampak sel darah merah dalam berbagai ukuran. Hal ini diakibatkan
karena ikan mengalami anemia. Anisositosis adalah kondisi dimana eritrosit
memiliki variasi ukuran dikarenakan adanya makrosit dan atau mikrosit diantara
normosit (Brokus, 2003)
Jumlah heterofil (neutrofil) meningkat jika di bandingkan
dengan standar normal, hal ini menunjukkan ikan tersebut mengalami heterofilia.
Heterofilia atau peningkatan heterofil dapat terjadi akibat peningkatan
kebutuhan jaringan untuk proses fagositosis (peradangan) akibat adanya infeksi
sekunder bakteri (Feldman dkk., 2000)
Leukopenia merupakan penurunan jumlah leukosit pada sirkulasi, yang dapat
disebabkan infeksi bakteri, dimana leukosit ditarik ke jaringan yang mengalami
infeksi sehingga terjadi penurunan leukosit dalam sirkulasi sampai terjadi
produksi leukosit kembali (Benjamin, 1978). Menurut Noga E.J (2000), infeksi
yang disebabkan oleh bakteri Aeromonas
hydrophila akan menyebabkan terjadinya penurunan jumlah limfosit,
peningkatan monosit serta peningkatan granulosit.
Limfopenia sering terjadi pada infeksi berat, penyakit hati, ginjal dan
penyakit saluran pencernaan.
Perhitungan monosit menunjukkan peningkatan yang berarti ikan
mengalami monositosis. Monositosis dapat distimuli oleh infeksi kronis. Peningkatan monosit
adalah respon dari kebutuhan tubuh untuk destruksi patogen yang sulit ditangani
oleh neutrofil (Schalm dkk, 1975). Monosit berfungsi sebagai fagosit dan
dipengaruhi oleh sitokin. Mononuklear fagosit umumnya menandakan radang kronis.
KESIMPULAN DAN SARAN
Kesimpulan
Berdasarkan
hasil pemeriksaan patologi, parasitologi, mikrobiologi, dan patologi klinik,
ikan mas (Cyprinus carpio) dengan nomor protokol E.42 terifestasi Dactylogyrus sp dan terinfeksi Aeromonas hydrophila.
Saran
Pencegahan penularan
penyakit dapat dilakukan dengan cara memisahkan antara ikan yang sakit dengan
ikan sehat. Untuk mengurangi tingkat penyakit yang disebabkan stres, dapat
dilakukan dengan memperbaiki kualitas air, mengatur kepadatan populasi dan
perbaikan pakan. Pengobatan
terhadap ikan yang terinfeksi Aeromonas
sp. dapat dengan menggunakan kalium permanganat sebanyak 20 gram/ m3
air selama 30-60 menit dan diulang selama 3-4 hari. Pengobatan terhadap infestasi
Dactylogyrus dapat dengan cara
perendaman ikan yang terserang ke dalam larutan amonium 1:2000 selama 5 - 15
menit. Dapat juga dengan perendaman dalam larutan Methylene Blue (1
gram/100 cm3 air).
DAFTAR PUSTAKA
Abulhamd, Ashraf T. 2009. Characterization of Aeromonas
hydrophila Isolated from Aquatic Environments Using Phenotypic and
Genotyping Methods. Research Journal of Agriculture and Biological Sciences,
5(6): hal: 923-931, 200.
Adanir, D., Turutoglu, H. 2007. Isolation and Antibiotic Susceptibility
of Aeromonas Hydrophila in a Carp (Cyprinus Carpio) Hatchery Farm. Bul Vet
Inst Pulawy Hal: 361-364.
Afrianto
dan Liviawaty, 1992. Pengendalian Hama dan Penyakit Ikan. Penerbit
Kanisius. Yogyakarta . Hal 89.
Aird,
Betsy. 2000. Clinical and Hematologic Manifestations of Anemia in Feldman, B.
F, Joseph G. Z dan Nemi C. J. 2000. Schalm’s Veterinary Hematology 5thedition.
Lippincott Williams and Wilkins. Hal: 1124
Anonim. 2000. Monogenea Classification. Class of
Platyhelminthes.General Information.http://images.google.co.id/imgres?imgurl=http://parasitology.informatik.uniwuerzburg.de/login2b.png&imgrefurl=http://parasitology.informatik.uniwuerzburg.
2 Mei 2010.
Anonim,
2004. Common Parasite of Fish by NT Lab. www. google./common Parasite
of Fish by NT Lab. . 2 Mei 2010.
Anonim. 2005. Parasitic disease of fish. www.google.com/parasitic
disease of fish. . 2 Mei 2010
Anonim. 2007. Chapter 3: Infectious Disease. www.google.com/Infectious
disease of fish. . 2 Mei 2010.
Anonim, 2008b. Goldfish, From
Wikipedia, The Free Encyclopedia.
Anonim, 2008c. Budidaya Ikan Mas.
Anonim, 2008d. Ikan
Karper, dari Wikipedia Indonesia, Ensiklopedia Bebas BerbahasaIndonesia. http://www.id.wikipedia.org/wiki/berkas:common_carp.jpg. . 2 Mei 2010
Asmat A dan gires U. 2002. The Occurrence of
Aerolysin-Positive Aeromonas hydrophila Strains in Seawater and associated With
Marine Copepods. Proceedings of the Regional
Symposium on Environment and Natural Resources 10-11th April 2002. Vol 1:Hal: 495-502.
Austin, B. and Austin, D.A., 1987, Bacterial Fish Pathogens: Disease in Farmed and Wild Fish, Ellis Horwood
Limited.Hal: 250-256.
Benjamin, M. M., 1978. Outline of Veterinary Clinicaly
Pathology Third Edition. The Lowa State Univercity Press. Ames, Lowa, USA. Hal. 47.
Brokus, Charles W. dan Claire B. 2003. Erythrocytes in Duncan Iowa : Iowa State University
Camus, A. C., R.M. Durborow, W.G. Hemstreet, R.L.
Thune1 dan J.P. Hawke. Aeromonas Bacterial Infections and Motile Aeromonad
Septicemia. SRAC Publication No. 478 1998.
Carnahan, A. M., S. Behram dan S. W. Joseph. 1991.
Aerokey II: A Flexibel Key for Identifying Clinical Aeromonas Species
Chong, Yunsop, Kui Nyung Yi dan Samuel Y. Lee.
1980. Cultural and Bhiochemical Characteristics of
Clinical Isolates of Aeromonas hydrophila. Yonsei Medical Journal
Vol. 27, No. 1. hal: 420.
Darvis, B. K; A. Haji M; A.
Mohamadi Z; S. V. Salehi Mir; M. M. Shakiban. 2009.Measurament of some hematological characteristic of the wil carp. Comp
Clin Pathol (2009)18 : hal: 321.
Dixon, B., 1990. Bacterial Infection in Fish.
Aquarium Fish Magazine, The May/ June 1990 Edition. Hal: 3.
Feldman, B.F., Zink J.G., and Jain, N.C. 2000. Schalm’s
Veterinary Hematology Fifth Edition. Lippincott Williams & Wilkins.
Philadelphia. Hal. 1124
Griffiths, D. 2008. Trematoda
Monogenea.
http://www.koiquest.co.uk/flukey%20devil.htm. 4 Mei 2010.
Govan A. D. T., Macfarlane P. S., Callander R.,1981. Pathology
Illustrated. Churchill Livingstone. Edinburgh. Hal: 3-9, 16.
Handajani and Samsundari, 2005. Parasit dan Penyakit Ikan. Universitas Muhammadiyah Malang Press,
Malang. Hal: 3-4, 76-77.
Ibrahem, Mai D., M. M. Mostafa, R. M. H. Arab dan
M. A. Rezk. 2008. Prevalence of Aeromonas hydrophila Infection In Wild
and Cultured Tilapia Nilotica (O.Niloticus) In Egypt. 8th
International Symposium on Tilapia in Aquaculture 2008. Hal: 92.
Irianto, A. 2005. Patologi Ikan
Teleostei. Gadjah Mada University Press, Yogyakarta. Hal: 131.
Ismargono. 1996. Penggunaan Jerami dalam
Pendadaran Benih Karper. Fakultas Pertanian UGM: Yogyakarta. Hal: 1.
Jenkins, Jill A. dan Peter W. Taylor. 1995. An Alternative
Bacteriological Medium for the Isolation of Aeromonas spp. Journal of Wildlife
Disease, 31 (2), 1995, hal: 272-275
Kaewviyudth,
S., Chinabut, S. 1999. Five New Species of Dactylogyrus (Monogenea) from
Cyprinid Fishes in Thailand
Kociba,
gary J. 2000. Macrocytosis in Feldman, B. F, Joseph G. Z dan Nemi C. J. 2000. Schalm’s
Veterinary Hematology 5thedition. Lippincott Williams and
Wilkins Pp 1124: Philadelphia
Kordi, M.G.H., 2004. Penanggulangan Hama dan Penyakit
Ikan.. PT. Rineka Cipta Bina Adiaksara: Jakarta. Hal: 26 – 46, 116-117.
Levine, N.D.1994. Buku Pelajaran Parasitologi
Veteriner , terjemahan Text Book of Veterinary Parasitology oleh Prof. Dr.
Gatut Ashadi. Gadjah Mada University Press. Yogyakarta. Hal: 95.
Lucky H.M., karsinah, Suharto. 1993. Mikrobiologi
kedokteran. Fakultas Kedokteran Universitas Indonesia. Jakarta. Hal: 154.
Muda, S. 2007. Budidaya Ikan Mas.
Moeller Jr., R.B, 2001. Bacterial Disease of Fish.
California Animal Health and Food Safety Laboratory System University of
Californian. www.google.com/BacterialDiseaseofFish.
Diakses pada tanggal 2 Mei 2010.
Noga,
E.J. 2000. Fish Disease. Diagnosis and
Treatment. Iowa
State University Iowa
Post, G. 1987. Textbook of Fish Health Sedond Edition.
T.F.H Publications, Inc. Neptune city. Hal: 38-40;137; 189-193; 206-209.
Quinn, P.j, B. K. Markey, M. E. Carter, W. J. C.
Donelly, dan F. C. Leonard. 2002. Veterinary Microbiology and Microbial
Disease. British :
Blackwell Science. Hal 32.
Reed,
P., Ruth, F.P., Ruth, E.K. 2005. Monogenean
Parasites of Fish. http://edis.ifas.ufl.edu/scripts/FA033.
Diakses pada tanggal 6 Oktober 2009.
Roberts,
R.J.1989. Field and Laboratory
Investigations into Ulcerative Fish Disease in the Asia-Pasific Region. FAO
Project. Bangkok
Robert,
R.J. 2001 The Parasitology of Teleosts.
In:Fish Pathology. W.B Saunders: Toronto
Schalm, O.W., Jain, N.C., and Carrol, E.J. 1975. Veterinary
Hematology Third Edition. Lea & Febiger. Philadelphia. Hal: 462, 522.
Sirirat, T, J. Intuseth, J. Chanpong, K. Thompson, S. Chinarit dan
A. adams . 1999. Characterisation of Aeromonas
hydrophila Extracelluler Products with Reference to Toxicity, Virulence,
Protein Profiles and Antigenicity. Asian Fisheries Science 12 (1999) :Hal: 371-379.
White, R. 1991. Diagnosis of Aeromonas hydrophila
infection in fish. Newsletter. www. Animal Disease Diagnostic
Laboratory.com. 4 Mei 2010.
Yambot, A. V. 1998. Isolation of Aeromonas
hydrophilla from Oreochromis niloticus during Fish Disease Outbreaks
in the Philippines. Asian fisheries Science 10
(1998); Hal:
347-354













0 komentar:
Posting Komentar